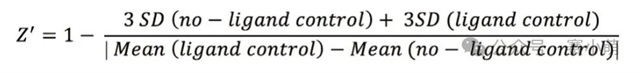新闻中心
在探索生命奥秘的征途上,蛋白质-相互作用(PPI)的研究至关重要。传统的BRET(生物发光共振能量转移)技术曾是研究细胞动态事件的有力工具,但其应用却常常受限。
生物发光共振能量转移(BRET)检测试剂盒由Promega在20世纪90年代末开发,对于理解细胞动态事件至关重要,特别是蛋白相互作用(PPI)。在BRET中,发光供体的激发态能量可以转移到受体荧光素,导致受体分子以特征发射波长发出。这些类型的检测试剂盒迅速成为测量PPI的有用工具,它们不仅被认为是通用的、快速的和生物学上有用的,而且也适合用于PPI调节的活细胞药物发现的高通量筛选。然而,传统的BRET技术存在一些局限性:
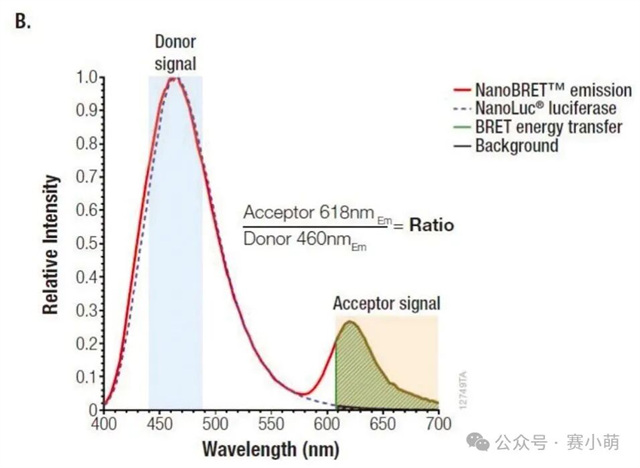
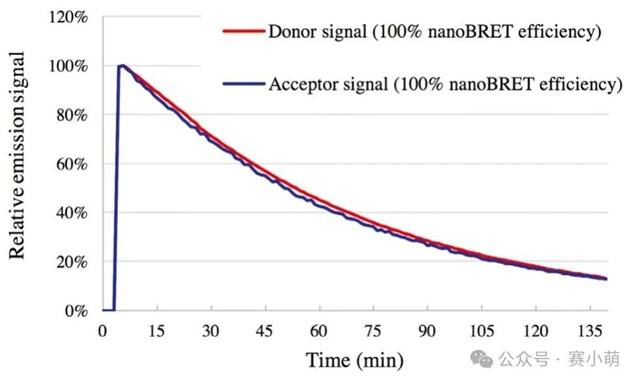
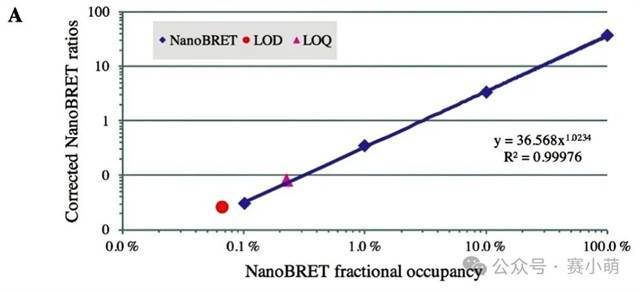
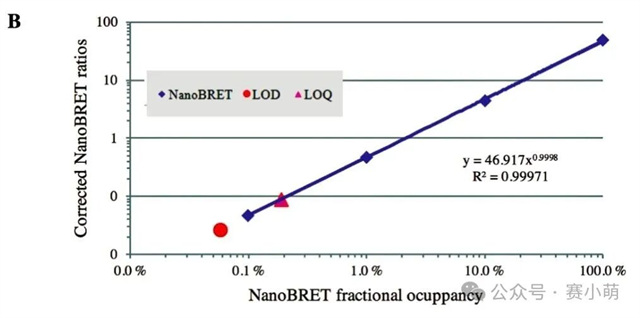
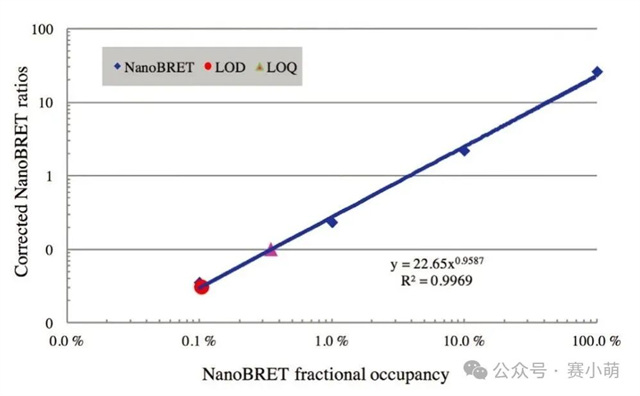
Promega公司推出的NanoBRET™消除了所有的限制。在NanoBRET™中,可以使用一种新的、效率高得多的供体-受体对来研究PPI(见图1)。这一新组合包括一个非常亮的荧光素酶(NanoLuc)作为能量供体,以及一个用荧光标记的Halotag融合蛋白作为能量受体。 图 1. NanoBRET™检测 A中:使用NanoBRET研究蛋⽩质A和B之间的相互作用。供体是NanoLuc®‑蛋⽩质A融合体,受体是荧光标记的HaloTag®‑蛋⽩质B融合体。 B中:显示了NanoBRET的分离光谱和计算方法。 新的供体(NanoLuc)尺寸小(19kD),发射信号强(460nm发射峰),并且发射光谱较窄,降低了供体信号“溢漏”到受体发射通道的可能性。 选择红色荧光素酶作为BRET配体 (618nm发射) 通过共价键连接到HaloTag,这允许相当大的光谱分离(超过150nm),从而确保非常高的信噪比。 然而,尽管比典型的BRET检测方法优越,NanoBRET的性能仍然取决于选择合适的酶标仪。Promega强烈建议使用能够测量双滤光片波长的仪器,Thermo Scientific Varioskan LUX多功能酶标仪具备测量双滤光片波长的能力,非常适合进行NanoBRET™检测。 选择次优滤光片可能会损害试验性能并降低数据质量。根据Promega的说法,理想情况下供体信号应该用中心波长为460nm的带通滤光片(BP)和一个从600-610nm开始的长通滤光片(LP)来测量,以收集所有受体发射信号。使用适当的LP滤光片收集受体信号对于确保检测试剂的灵敏度尤为重要。 96孔板和384孔板,1X PBS/0.1%BSA,NanoBRET™控制蛋白组,NanoBRET™ Nano-Glo®底物。 用1X PBS/0.1%BSA稀释NanoBRET Nano-Glo底物,稀释250倍制备成2X溶液。将不同浓度的反应液每孔加50µl,并加入等量的2X NanoBRET Nano-Glo底物 (50µl)。最后一种试剂用Varioskan LUX添加。在加入底物后10分钟内,使用Varioskan LUX和选择的滤光片检测供体和受体发射光信号。 仪器启动前,需要安装适当的滤光片。为此,请按照仪器手册中的说明将滤光片安装到Varioskan LUX中。需要注意的是,在安装F600LP或F610LP滤光片时,即使这些滤光片没有波长范围,也必须在Thermo Scientific SkanIt™软件中定义一个波长范围,可以设置600-999nm。 添加一个动力学环,选择总时间(或读数次数)和动力学间隔。在此测试中,以1分钟为间隔进行20次读数。注意:反应开始后的前10分钟内,受体和供体发射信号的动力学衰减非常显著(如图2所示)。然而,供体和受体信号的衰减速度保持不变,因此在较长的测量时间内计算出的NanoBRET比值不会受到影响。 图2 在本次案例中,在读数为1时用中高速自动分液50µl NanoBRET Nano-Glo底物。 选择用于测量NanoBRET的滤光片对,并设置1000毫秒的测量时间,使用自动增益。 注意:通常情况下,改变增益以增强受体发射信号并不能改善NanoBRET结果(改变增益会同时放大信号和背景噪声)。然而,在受体发射信号饱和的情况下,可以降低增益以获得非饱和读数。 在0%浓度(没有nanoBRET信号)和100%浓度(最大nanoBRET信号)的孔中测量受体和发射光谱。使用波长范围为400–700nm(以1nm步进),测量时间为100ms。 通过将受体发射信号值除以供体发射信号值(Acceptor Em/Donor Em)来计算每个样本的NanoBRET比值。 通过从样品中减去对照(无相互作用)的NanoBRET比值来计算校正后的NanoBRET比值。 对校正后的 NanoBRET 比值与浓度的依赖关系进行线性回归分析,并计算曲线的斜率。 如果仪器正确地检测到NanoBRET信号,应该获得一条线性曲线。使用以下公式计算定量限(LOQ)和检测限(LOD)。注意:无相互作用对照(下图)对应于0%浓度样本。 使用NanoBRET比值的均值和标准差来计算每个浓度筛选窗口系数值(Z’)以评估该检测方法在各个浓度下的性能: 使用Promega控制蛋白组进行的NanoBRET检测显示,在96孔板中,使用两种不同的发射滤光片收集受体信号时,Varioskan LUX 检测到的NanoBRET信号保持线性(图3)。 图3 当使用波长为600或610nm滤光片收集受体信号时,仪器性能指标LOQ和LOD值也高度相似(表1)。使用Varioskan LUX,两种情况下的LOQ浓度都在0.2%左右,表明相对于总供体群体,含有0.2%供体受体(BRET)对的样本从统计上与只含有供体分子的样本区分开来。 NanoBRET是一种出色的筛选工具。根据这里获得的结果,还可以得出结论:在1%最大NanoBRET效率下进行筛选优化,无论Varioskan LUX测量时采用哪个NanoBRET受体发射滤光片(600或610nm),都可以产生极好的质量参数(Z' > 0.8)。 当在384孔板中运行时,该分析方法也表现良好。在这种情况下测量的最低检出限 (LOD) 只轻微增加到0.35%(图4)。这使得NanoBRET和Varioskan LUX的结合对于大型化学抑制剂筛选受体供体对的检测非常有用。 图4 在Varioskan LUX中选择多重化学发光检测滤光片,可实现NanoBRET 的性能,这是一种由Promega开发的技术,非常适合对活细胞中的蛋白质相互作用进行动态研究。我们建议使用中心波长约为460nm(发射波长为450nm,带宽为80nm)的带通 (BP) 滤光片测量供体发射信号,使用起始波长为600或610nm的长通 (LP) 滤光片测量受体发射信号。